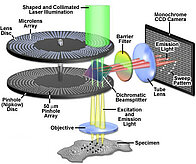
Principle
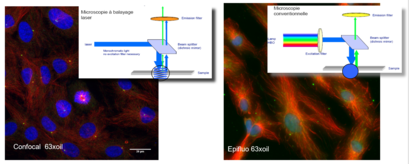
In conventional epi-fluorescence microscopy, one of the major problems is the presence of a significant background noise related to the thickness of the observed object. Although the focus is on a precise focal plane, the recording of the information is marred by a background noise that is superimposed on the image of the observed plane: this noise results from the excitation, by the light source, of all the fluorochromes located on the light path.
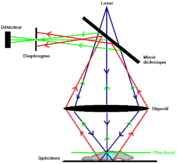
The confocal microscope acts like an optical microtome, its principle is to focus, through an objective, a laser beam that will excite the fluorochromes in a point of the sample, then to recover, on a photomultiplier, the light signal emitted in this point.
A diaphragm (pinhole) that stops any signal not coming from the focal plane is placed in front of the photomultiplier. The received signal is amplified in the photomultiplier, processed to improve the signal-to-noise ratio, then digitized. The image is built point to point by scanning (X,Y) the analyzed field with the help of deflection mirrors of the light source. A motorized plate moves the preparation along the Z axis allowing the capture of different optical planes in the thickness of the object. The images thus formed are stored in the memory of a computer.
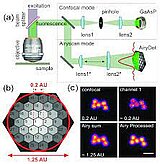
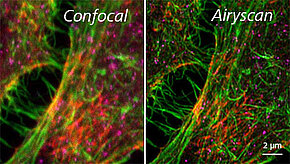
The use of the airyscan resolution enhancement module, introduces a new detector design for confocal laser scanning microscopy (LSM). While traditional LSM designs use a combination pinhole and point-to-point detector, the airyscan is a 32-channel gallium arsenide-gallium phosphide photomultiplier tube (GaAsP-PMT) area detector that collects an optically sectioned image at each scan position. Each detector element functions as a smaller aperture pinhole (0.2 AU). Knowledge of the beam path and spatial distribution of each detector channel allows for very light-efficient imaging with improved resolution and signal-to-noise ratio.
The Spinning-Disk confocal microscope allows to obtain an image with an axial resolution close to the one obtained with a laser scanning confocal. Moreover, it allows very fast acquisitions and limits photobleaching and phototoxicity for long term observations.
The illumination source used is usually a laser. The path of the excitation light passes through a part of the pinhole disk which will divide the illumination of the sample into several hundred points.
A disc of microlenses allows to focus the light on the pinholes and to reduce the loss of light. When the disk rotates (from 1500 rpm to 5000 rpm depending on the version). The fluorescence re-emitted by the sample is collected by the objective before crossing the pinholes disk. The pinholes allow only the fluorescence rays perpendicular to the disk and coming from the focal plane of the objective to pass through and then be sent to the camera. The high rotation speed of the disk and the excitation at a relatively low light level allows very fast acquisitions and limits considerably the photobleaching and phototoxicity.
The live-SR module, combined with the rotation of the disk, allows to improve the signal-to-noise ratio of the image and improves the resolution by a factor of 2 (105 nm with the 100xSR objective) while keeping the acquisition speed of the spinning disk, up to 1000 images per second. It is a solution very well adapted to high-resolution cellular imaging of weakly labeled and/or photobleaching sensitive samples. The technique is based on a structured illumination technique, optically demodulated with deconvolution processing.
Campus CS
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête confocale LSM 700
- Détecteur : PMT 32 Quasar
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Module FRAP pour suivi de molécules.
- Module FRET pour analyse de proches interactions.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Cité Scientifique - Bâtiment SN3, Sous-sol
Contact : Elodie Richard | 03.20.43.44.27
Tarif : 20€/heure
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête confocale LSM 780
- Détecteur : PMT 32 Quasar
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Module FRAP pour suivi de molécules.
- Module FRET pour analyse de proches interactions.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Cité Scientifique - Bâtiment SN3, Sous-sol
Contact : Elodie Richard | 03.20.43.44.27
Tarif : 20€/heure
Campus Santé
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête confocale LSM 710
- Détecteur : PMT 32 Quasar
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
- Accessoires : Detecteur Airyscan
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Amélioration de la résolution via l'utilisation de l'Airyscan (120 nm)
- Module FRAP pour suivi de molécules.
- Module FRET pour analyse de proches interactions.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Faculté de Médecine - Bâtiment Plateformes-Cancer
Contact : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Tarif : 20€/heure
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Blue
- Lasers (nm) : 405 / 488 / 561 / 635
- TL : BF / DIC / PH
- Modalité : Tête Spinning-Disk Yokogawa CSU-X1
- Caméra : sCMOS Photometrics PRIME 95b
- Objectifs : 10x/0.3 | 20/0.4 LD | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | 100x/1,4(oil)
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
- Accessoires : Pompe péri statique pour micro-fluidique
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 4 couleurs de 400nm à 750nm.
- Transmission, contraste interférentiel de Nomarski (DIC), contraste de phase.
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Faculté de Médecine - Bâtiment Plateformes-Cancer
Contact : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Tarif : 20€/heure
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Blue
- Lasers (nm) : 405 / 488 / 561 / 633 / 740
- TL : BF / DIC
- Modalité : Tête confocale LSM 980
- Détecteur : Gasp 32 Quasar + NIR
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
- Accessoires : Detecteur Airyscan 2
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 800 nm.
- Amélioration de la résolution via l'utilisation de l'Airyscan 2 (120 nm)
- Module FRAP pour suivi de molécules.
- Module FRET pour analyse de proches interactions.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Faculté de Médecine - Bâtiment Plateformes-Cancer
Contact : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Tarif : 22€/heure
Description :
- Marque : Leica Stellaris 5
- Type de statif : Inversé
- Logiciel : LAS X
- Lasers (nm) : 405 / 488 / 561 / 633
- TL : BF
- Modalité : Tête confocale Stellaris 5
- Détecteur : Gasp 32 Quasar
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750 nm.
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
Localisation : Faculté de Médecine - Bâtiment Plateformes-Cancer
Contact : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Campus Pasteur
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête confocale LSM 880
- Détecteur : Gasp 32 Quasar
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
- Accessoires : Detecteur FAST-Airyscan
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Amélioration de la résolution via l'utilisation de l'Airyscan (120 nm)
- Amélioration de la vitesse d'acquisition grâce à la tête GASP LSM 880
- Amélioration de la sensibilité grâce à la tête GASP LSM 880
- Module FRAP pour suivi de molécules.
- Module FRET pour analyse de proches interactions.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Institut Pasteur de Lille - Institut de Biologie de Lille, 2ème étage
Contact : Elisabeth Werkmeister | Sophie Salomé-Desnoulez | 03.20.87.10.40
Tarif : 20€/heure
Description :
- Marque : Zeiss Axio Imager Z1
- Type de statif : Droit
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête confocale LSM 710
- Détecteur : PMT 32 Quasar
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Observation de l'échantillon par le dessus
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées multi-position et mosaïque.
Localisation : Institut Pasteur de Lille - Institut de Biologie de Lille, 2ème étage
Contact : Elisabeth Werkmeister | Sophie Salomé-Desnoulez | 03.20.87.10.40
Tarif : 20€/heure
Description :
- Marque : Nikon
- Type de statif : Inversé
- Logiciel : Metamorph
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête Spinning Disk Yokogawa CSU-W1
- Détecteur : Caméra
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom optique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : Okolab
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Perfect Focus
- Accessoires : Module Live-SR
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Amélioration de la résolution via l'utilisation du Live-SR (120 nm)
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque en LNSB2
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Institut Pasteur de Lille - Institut de Biologie de Lille, 5ème étage (LNSB2)
Contact : Elisabeth Werkmeister | Sophie Salomé-Desnoulez | 03.20.87.10.40
Tarif : 20€/heure
Description :
- Marque : Nikon
- Type de statif : Inversé
- Logiciel : NIS Elements
- Lasers (nm) : Lumencore Celesta 7 Lines 408 / 445 / 473 / 518 / 545 / 635 / 750
- Filtres d’émission: DAPI, FITC, TRITC, Cy5, Cy7
- TL : BF
- Modalité : Tête Spinning Disk CREST X-Light V3
- Détecteur : 1 caméra Photometrics Prime BSI
- Objectifs : 20x/0.75 | 40x/1,3 (oil) | 63x/1,4 (oil) | 100x/1,45 (oil)
- Platine : Motorisée et Z Piezo
- Chambre d'incubation Temp. et CO2 : Okolab
- Supports : Lames et dishes 15mm / Plaques multi-puits
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Perfect Focus
- Accessoires : Module de déconvolution et d'amélioration de résolution par intelligence artificielle
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détections en séquentiel de 4 couleurs et simultanée de 2 couleurs.
- Imagerie de haute résolution en Live-SR (taille pixel live SR 100X oil :0.065µm)
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions temporelles à cadensage rapide (mode dual-cam, multi-position, maintient de focus, contrôle de la température et du C02). Applicable sur des échantillons infectieux manipulés en L2.
- Suivie de dynamiques moléculaires par FRAP (fluorescence recovery after photobleatching).
- Applications en TIRF (total internal reflection fluorescence) pour l’imagerie à faible profondeur des phénomènes observables à ou sous la membrane cellulaire.
- Étude d’interaction moléculaire par FRET (Föster resonance energy transfer) (couple GFP/RFP, CFP/YFP) en acquisition temporelle.
Localisation : Institut Pasteur de Lille - Institut de Biologie de Lille, 5ème étage (LNSB2)
Contact : Sophie Salomé-Desnoulez | 03.20.87.10.40

![[Translate to English:] Accès à l'un des organismes partenaires : CNRS [Translate to English:] Organisme partenaire](/fileadmin/_processed_/0/1/csm_CNRS_3a745ef80f.png)
![[Translate to English:] Accès à l'un des organismes partenaires : INSERM [Translate to English:] Organisme partenaire](/fileadmin/_processed_/f/f/csm_1200px-Inserm.svg_e391664898.png)
![[Translate to English:] Accès à l'un des organismes partenaires : CHU Lille [Translate to English:] Organisme partenaire](/fileadmin/_processed_/b/b/csm_chu_25c6c9f960.png)
![[Translate to English:] Accès à l'un des organismes partenaires : Institut Pasteur de Lille [Translate to English:] Organisme partenaire](/fileadmin/_processed_/6/1/csm_pasteur_21b9760e1f.png)