Microscopía confocal y disco giratorio
Principio
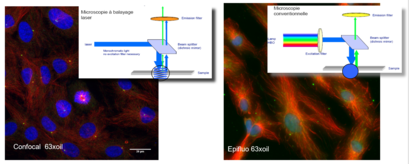
En la microscopía de epifluorescencia convencional, uno de los principales problemas es la presencia de un importante ruido de fondo relacionado con el grosor del objeto observado. Aunque el foco está en un plano focal preciso, el registro de la información se ve empañado por el ruido de fondo que se superpone a la imagen del plano observado: este ruido resulta de la excitación, por parte de la fuente de luz, de todos los fluorocromos situados en el trayecto de la luz.
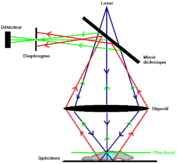
El microscopio confocal actúa como un micrótomo óptico, su principio consiste en enfocar, a través de un objetivo, un rayo láser que excitará los fluorocromos en un punto de la muestra, para luego recuperar, en un fotomultiplicador, la señal luminosa emitida en este punto.
Se coloca un agujero de alfiler delante del fotomultiplicador para detener cualquier señal que no provenga del plano focal. La señal recibida se amplifica en el fotomultiplicador, se procesa para mejorar la relación señal/ruido y se digitaliza. La imagen se construye punto por punto escaneando (X,Y) el campo analizado con la ayuda de espejos de desviación de la fuente de luz. Una platina motorizada desplaza la preparación a lo largo del eje Z, permitiendo la captura de diferentes planos ópticos en el espesor del objeto. Las imágenes resultantes se almacenan en la memoria de un ordenador.
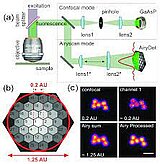
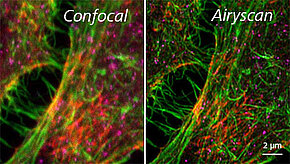
El uso del módulo de mejora de la resolución Airyscan introduce un nuevo concepto de detector para la microscopía de escaneo láser confocal (LSM). Mientras que los diseños tradicionales de LSM utilizan una combinación de detector estenopeico y punto a punto, el airyscan es un detector de área de tubo fotomultiplicador de arseniuro de galio (GaAsP-PMT) de 32 canales que recoge una imagen seccionada ópticamente en cada posición de exploración. Cada elemento del detector funciona como un agujero de alfiler de menor apertura (0,2 UA). El conocimiento de la trayectoria del haz y de la distribución espacial de cada canal del detector permite obtener imágenes de gran eficiencia lumínica con una mejor resolución y relación señal-ruido.
El microscopio confocal Spinning-Disk permite obtener una imagen con una resolución axial cercana a la obtenida con un confocal de barrido láser. Además, permite adquisiciones muy rápidas y limita el fotoblanqueo y la fototoxicidad para las observaciones a largo plazo.
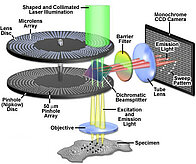
La fuente de iluminación utilizada suele ser un láser. La trayectoria de la luz de excitación pasa por una parte del disco estenopeico que dividirá la iluminación de la muestra en varios cientos de puntos.
Se utiliza un disco de microlente para enfocar la luz en los agujeros de los alfileres y así reducir las pérdidas de luz. Cuando el disco gira (de 1500 rpm a 5000 rpm según la versión). La fluorescencia reemitida por la muestra es recogida por el objetivo antes de pasar por los agujeros de los alfileres. Los agujeros de alfiler sólo dejan pasar los rayos de fluorescencia perpendiculares al disco y procedentes del plano focal del objetivo, que se envían a la cámara. La alta velocidad de rotación del disco y la excitación a un nivel de luz relativamente bajo permiten adquisiciones muy rápidas y limitan considerablemente el fotoblanqueo y la fototoxicidad.
El módulo Live-SR, combinado con la rotación del disco, mejora la relación señal-ruido de la imagen y mejora la resolución en un factor de 2 (105 nm con el objetivo 100xSR), manteniendo la velocidad de adquisición del disco giratorio, hasta 1000 fotogramas por segundo. Es una solución muy adecuada para la obtención de imágenes celulares de alta resolución de muestras débilmente marcadas y/o sensibles al fotoblanqueo. La técnica se basa en una técnica de iluminación estructurada, demodulada ópticamente con procesamiento de deconvolución.
Campus CS
Descripción :
- Marca: Zeiss Axio Observer Z1
- Tipo de soporte : Invertido
- Software: ZEN Black
- Láseres (nm): 405 / 488 / 555 / 639
- TL : BF / DIC
- Modalidad : Cabezal confocal LSM 700
- Detector : 2 PMT + T-PMT (transmisión)
- Objetivos: 10x/0,3 | 40x/1,4 (aceite) | 63x/1,4 (aceite) | Zoom digital
- Etapa: Manual
- Cámara de incubación de temperatura y CO2 : PECON
- Soportes : Portaobjectos / Placas multipozo
- Z-Stacks : Sí
- Mosaicos : No
- Multiposiciones : No
Aplicaciones :
- Observación 2D o 3D de cortes ópticos en fluorescencia.
- Detección de 400nm a 750nm.
- Módulo FRAP para el seguimiento de moléculas.
- Transmisión, contraste de interferencia de Nomarski (DIC).
- Adquisiciones de tiempo automatizadas
- Incubadora que controla la temperatura y el suministro de CO2.
Localización : Cité Scientifique - Edificio SN3, sala 207
Contacto : Elodie Richard | 03.20.43.44.27
Precio : 20€/hora
Descripción :
- Marca: Zeiss Axio Observer Z1
- Tipo de soporte : Invertido
- Software : ZEN Black
- Laseres (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalidad : Cabeza confocal LSM 780
- Detector : PMT 32 Quasar + T-PMT (transmisión)
- Objectivos : 10x/0.3 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom digital
- Plata : Motorizada
- Chambre d'incubation Temp. et CO2 : PECON
- Admite : Portaobjetos / Placas multipozo
- Z-Stacks : Sí
- Mosaicos : Sí
- Multiposiciones : Sí
- Mantener el enfoque: Enfoque definitivo
Aplicaciones :
- Observación 2D o 3D de cortes ópticos en fluorescencia.
- Detección simultánea de 6 colores de 400nm a 750nm.
- Módulo FRAP para el seguimiento de moléculas.
- Módulo FRET para el análisis de interacciones estrechas.
- Desmezcla lineal para el análisis espectral de señales.
- Transmisión, contraste de interferencia de Nomarski (DIC).
- Adquisiciones automáticas de tiempo, multiposición y mosaico.
- Sistema de autoenfoque integrado para eliminar la deriva Z.
- Incubadora con control de temperatura y CO2.
Localización : Cité Scientifique - Edificio SN3, Sala 207
Contacto : Elodie Richard | 03.20.43.44.27
Precio : 20€/hora
Campus Santé
Descripción :
- Marca : Zeiss Axio Observer Z1
- Tipo de soporte: Invertido
- Software: ZEN Black
- Laseres (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalidad: Cabeza confocal LSM 710
- Detector : PMT 32 Quasar
- Objectivos : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom digital
- Placa : Motorizada
- Cámara de incubación Temp. y CO2 : PECON
- Admite: Portaobjetos / Placas multipozo / Portaobjetos multicámara
- Z-Stacks : Sí
- Mosaicos : Sí
- Multiposiciones: Sí
- Mantener el enfoque: Enfoque definitivo
- Accesorios : Detector Airyscan
Aplicaciones :
- Observación 2D o 3D de cortes ópticos en fluorescencia.
- Detección simultánea de 6 colores de 400nm a 750nm.
- Resolución mejorada gracias al uso del Airyscan (120 nm)
- Módulo FRAP para el seguimiento de moléculas.
- Módulo FRET para el análisis de interacciones estrechas.
- Desmezcla lineal para el análisis espectral de señales.
- Transmisión, contraste de interferencia de Nomarski (DIC).
- Adquisiciones automáticas de tiempo, multiposición y mosaico.
- Sistema de autoenfoque integrado para eliminar la deriva Z.
- Incubadora con control de temperatura y CO2.
Localización: Facultad de Medicina - Edificio Plataformas-Cancer
Contacto : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Precio : 20€/hora
Descripción :
- Marca : Zeiss Axio Observer Z1
- Tipo de soporte : Inversé
- Software: ZEN Blue
- Laseres (nm) : 405 / 488 / 561 / 635
- TL : BF / DIC / PH
- Modalidad : Cabezal de disco giratorio Yokogawa CSU-X1
- Cámara : sCMOS Photometrics PRIME 95b
- Objectivos : 10x/0.3 | 20/0.4 LD | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | 100x/1,4(oil)
- Placa : Motorizada
- Cámara de incubación Temp. et CO2 : PECON
- Admite : Portaobjetos / Placas multipozo / Portaobjetos multicámara
- Z-Stacks : Sí
- Mosaicos : Sí
- Multiposiciones : Sí
- Mantener el enfoque: Enfoque definitivo
- Accessorios : Bomba peristáltica para microfluidos
Aplicaciones :
- Observación 2D o 3D de cortes ópticos en fluorescencia.
- Detección simultánea de 4 colores de 400nm a 750nm.
- Transmisión, contraste de interferencia de Nomarski (NIC), contraste de fase.
- Adquisiciones automatizadas de lapso de tiempo, multiposición y mosaico.
- Sistema de autoenfoque integrado para eliminar la deriva Z.
- Incubadora con control de temperatura y CO2.
Localización : Facultad de Medicina - Edificio Plataformas-Cancer
Contacto : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Precio : 20€/hora
Campus Pasteur
Descripción :
- Marca : Zeiss Axio Observer Z1
- Tipo de soporte : Invertido
- Software : ZEN Black
- Laseres (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalidad : Cabeza confocal LSM 880
- Detector : Gasp 32 Quasar
- Objectivos : 10x/0.3 | 40x/1 (water) | 40x/1,3 (oil) | 63x/1,4 (oil) | Zoom digital
- Placa : Motorizada
- Cámara de incubación Temp. et CO2 : PECON
- Admite : Portaobjetos / Placas multipozos / Portaobjetos multicámaras
- Z-Stacks : Sí
- Mosaicos : Sí
- Multiposiciones : Sí
- Mantener el enfoque: Enfoque definitivo
- Accesorios : Detector FAST-Airyscan
Aplicaciones :
- Observación 2D o 3D de cortes ópticos en fluorescencia.
- Detección simultánea de 6 colores de 400nm a 750nm.
- Resolución mejorada gracias al uso del Airyscan (120 nm)
- Mejora de la velocidad de adquisición gracias al cabezal LSM 880 GASP
- Sensibilidad mejorada con el cabezal LSM 880 GASP
- Módulo FRAP para el seguimiento de moléculas.
- Módulo FRET para el análisis de interacciones estrechas.
- Desmezcla lineal para el análisis espectral de señales.
- Transmisión, contraste de interferencia de Nomarski (DIC).
- Adquisiciones automáticas de tiempo, multiposición y mosaico.
- Sistema de autoenfoque integrado para superar el fenómeno de la deriva Z.
- Seguimiento de la dinámica molecular y celular a lo largo del tiempo (con control de temperatura y CO2).
Localización : Instituto Pasteur de Lille - Instituto de Biología de Lille, 2o piso
Contacto : Sophie Salomé-Desnoulez | 03.20.87.10.40
Precio : 20€/hora
Descripción :
- Marca : Zeiss Axio Imager Z1
- Tipo de soporte : Recto
- Software : ZEN Black
- Laseres (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalidad : Cabeza confocal LSM 710
- Detector : PMT 32 Quasar, 2 GAsp BIG
- Objectivos : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom digital
- Placa : Motorizada
- Admite : Portaobjetos, Caja de 35 mm (imagen de inmersión en agua)
- Z-Stacks : Sí
- Mosaicos : Sí
- Multiposiciones : Sí
Aplicaciones :
- Observación 2D o 3D de cortes ópticos en fluorescencia.
- Obtención de imágenes de muestras gruesas, sumergidas en medios acuosos (esferoides de matrigel, drosophila, etc.)
- Observación de las muestras fijas montadas entre el portaobjetos y el cubreobjetos.
- Detección simultánea de 6 colores de 400nm a 750nm.
- Desmezcla lineal para el análisis espectral de señales.
- Transmisión, contraste de interferencia de Nomarski (DIC).
- Adquisiciones automatizadas de múltiples posiciones y mosaicos.
Localización : Instituto Pasteur de Lille - Instituto de Biología de Lille, 2º piso
Contacto : Sophie Salomé-Desnoulez | 03.20.87.10.40
Precio: 20€/hora
Descripción :
- Marca : Nikon - Gataca Systems
- Tipo de soporte : Invertido
- Software : Metamorph
- Laseres (nm) : 405 / 452 / 488 / 514 / 561 / 633
- Filtros de emisión: DAPI, CFP, GFP, YFP, dsRed, FarRed
- TL : BF / DIC
- Modalidad : Cabeza de disco giratorio Yokogawa CSU-W1
- Detector: 2 cámaras Prime 95B
- Objectivos : 20x/0.75 | 40x/0,95 | 40x/1,3 (oil) | 63x/1,27 (water) | 60x/1,4 (oil) | 100x/1,49 (oil) Zoom óptico
- Placa : Motorizada y Z Piezo
- Cámara de incubación Temp. et CO2 : Okolab
- Admite : Portaobjetos / Placas de multipocillos / Portaobjetos multicámara
- Z-Stacks : Sí
- Mosaicos : Sí
- Multiposiciones : Sí
- Mantener el enfoque : Perfect Focus
- Accesorios : Módulo Live-SR (mejora óptica y deconvolución Rsr=Robj/1,67)
Aplicaciones :
- Observación 2D o 3D de cortes ópticos en fluorescencia.
- Detección secuencial de 4 colores y detección simultánea de 2 colores.
- Imágenes Live-SR de alta resolución (tamaño de píxel 100X live SR :0,065µm)
- Transmisión, contraste de interferencia de Nomarski (DIC).
- Adquisiciones rápidas de tiempo de encuadre (modo de doble cámara, multiposición, retención de enfoque, control de temperatura y CO2). Aplicable a las muestras infecciosas manipuladas en L2.
- Seguimiento de la dinámica molecular mediante FRAP (recuperación de la fluorescencia tras el fotoblanqueo).
- Aplicaciones en TIRF (fluorescencia de reflexión interna total) para la obtención de imágenes poco profundas de fenómenos observables en la membrana celular o por debajo de ella.
- Estudio de la interacción molecular por FRET (transferencia de energía de resonancia de Föster) (par GFP/RFP, CFP/YFP) en la adquisición de tiempo.
Localización : Instituto Pasteur de Lille - Instituto de Biología de Lille, 5o piso (LNSB2)
Contacto : Sophie Salomé-Desnoulez | 03.20.87.10.40

![[Translate to Spanish:] Accès à l'un des organismes partenaires : CNRS [Translate to Spanish:] Organisme partenaire](/fileadmin/_processed_/0/1/csm_CNRS_3a745ef80f.png)
![[Translate to Spanish:] Accès à l'un des organismes partenaires : INSERM [Translate to Spanish:] Organisme partenaire](/fileadmin/_processed_/f/f/csm_1200px-Inserm.svg_e391664898.png)
![[Translate to Spanish:] Accès à l'un des organismes partenaires : CHU Lille [Translate to Spanish:] Organisme partenaire](/fileadmin/_processed_/b/b/csm_chu_25c6c9f960.png)
![[Translate to Spanish:] Accès à l'un des organismes partenaires : Institut Pasteur de Lille [Translate to Spanish:] Organisme partenaire](/fileadmin/_processed_/6/1/csm_pasteur_21b9760e1f.png)