Microscopie confocale et spinning-disk
Principe
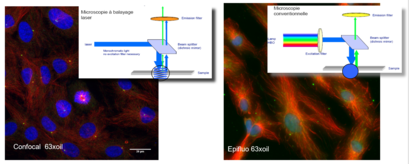
En microscopie classique à épi-fluorescence, un des problèmes majeurs est la présence d'un bruit de fond important lié à l'épaisseur de l'objet observé. Bien que la mise au point se fasse sur un plan focal précis, l'enregistrement de l'information est entaché d'un bruit de fond qui se superpose à l'image du plan observée : ce bruit résulte de l'excitation, par la source lumineuse, de tous les fluorochromes situés sur le trajet lumineux.
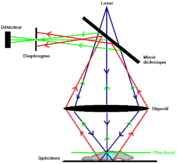
Le microscope confocal agit comme un microtome optique, son principe consiste à focaliser, par l'intermédiaire d'un objectif, un faisceau laser qui va exciter les fluorochromes en un point de l'échantillon, puis à récupérer, sur un photomultiplicateur, le signal lumineux émis en ce point.
Un diaphragme (pinhole) qui arrête tout signal ne provenant pas du plan focal est placé devant le photomultiplicateur. Le signal reçu est amplifié dans le photomultiplicateur, traité afin d'améliorer le rapport signal sur bruit, puis numérisé. L'image est construite point à point par balayage (X,Y) du champ analysé à l'aide de miroirs de déflection de la source lumineuse. Une platine motorisée déplace la préparation suivant l'axe Z permettant la saisie de différents plans optiques dans l'épaisseur de l'objet. Les images ainsi formées sont stockées sur la mémoire d'un ordinateur.
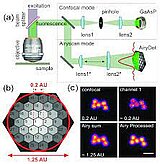
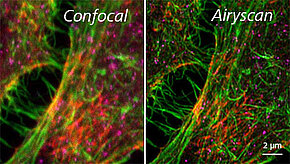
L'utilisation du module d'amélioration de résolution Airyscan, introduit un nouveau concept de détecteur pour la microscopie confocale à balayage laser (LSM). Alors que les conceptions LSM traditionnelles utilisent une combinaison de pinhole et de détecteur point-par-point, l'airyscan est un détecteur de zone à tube photomultiplicateur à l'arséniure de gallium et au phosphure de gallium (GaAsP-PMT) à 32 canaux qui collecte une image sectionnée optiquement à chaque position de balayage. Chaque élément détecteur fonctionne comme un pinhole d'ouverture plus petite (0.2 AU). La connaissance du trajet du faisceau et de la distribution spatiale de chaque canal de détection permet une imagerie très économe en lumière avec une résolution et un rapport signal/bruit améliorés.
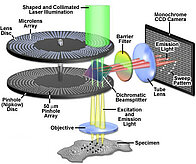
Le microscope confocal Spinning-Disk permet d'obtenir une image avec une résolution axiale proche de celle obtenue avec un confocal à balayage laser. De plus il permet des acquisitions très rapides et limite le photoblanchiment et la phototoxicité pour des observation de longues durées.
La source d'illumination utilisée est en général un laser. Le chemin de la lumière d’excitation passe par une partie du disque de pinhole qui va diviser l’illumination de l’échantillon en plusieurs centaines de points.
Un disque de microlentilles permet préalablement de focaliser la lumière sur les pinholes est ainsi de diminuer les pertes de lumière. Lorsque le disque tourne (de 1500 tours à 5000 tours/minute suivant les versions). La fluorescence réémise par l’échantillon est collectée par l’objectif avant de traverser le disque de pinholes. Ceux-ci ne laissent passer que les rayons de fluorescence perpendiculaires au disque et provenant du plan focal de l'objectif qui sont ensuite envoyés vers la caméra. La grande vitesse de rotation du disque ainsi que l'excitation à un niveau de lumière relativement bas permet des acquisitions très rapides et limite considérablement le photoblanchiment et la phototoxicité.
Le module live-SR, combiné à la rotation du disque, permet d’améliorer le rapport signal/bruit de l’image et améliore la résolution d’un facteur 2 (105 nm avec l’objectif 100xSR) tout en conservant la vitesse d’acquisition du spinning disk, jusqu'à 1000 images par seconde. C’est une solution tout à fait adaptée à l’imagerie cellulaire haute-résolution d’échantillons faiblement marqué et/ou sensible au photo-blanchiment. La technique est basée sur une technique d’éclairage structuré, démodulée optiquement avec traitement de déconvolution.
Campus CS
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 488 / 555 / 639
- TL : BF / DIC
- Modalité : Tête confocale LSM 700
- Détecteur : 2 PMT + T-PMT (transmission)
- Objectifs : 10x/0.3 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Manuelle
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits
- Z-Stacks : Oui
- Mosaïques : Non
- Multi-positions : Non
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection de 400nm à 750nm.
- Module FRAP pour suivi de molécules.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Cité Scientifique - Bâtiment SN3, Salle 207
Contact : Elodie Richard | 03.20.43.44.27
Tarif : 22€/heure
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête confocale LSM 780
- Détecteur : PMT 32 Quasar + T-PMT (transmission)
- Objectifs : 10x/0.3 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Module FRAP pour suivi de molécules.
- Module FRET pour analyse de proches interactions.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Cité Scientifique - Bâtiment SN3, Salle 207
Contact : Elodie Richard | 03.20.43.44.27
Tarif : 22€/heure
Campus Santé
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête confocale LSM 710
- Détecteur : PMT 32 Quasar
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
- Accessoires : Detecteur Airyscan
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Amélioration de la résolution via l'utilisation de l'Airyscan (120 nm)
- Module FRAP pour suivi de molécules.
- Module FRET pour analyse de proches interactions.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Faculté de Médecine - Bâtiment Plateformes-Cancer
Contact : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Tarif : 22€/heure
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Blue
- Lasers (nm) : 405 / 488 / 561 / 635
- TL : BF / DIC / PH
- Modalité : Tête Spinning-Disk Yokogawa CSU-X1
- Caméra : sCMOS Photometrics PRIME 95b
- Objectifs : 10x/0.3 | 20/0.4 LD | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | 100x/1,4(oil)
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
- Accessoires : Pompe péri statique pour micro-fluidique
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 4 couleurs de 400nm à 750nm.
- Transmission, contraste interférentiel de Nomarski (DIC), contraste de phase.
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Faculté de Médecine - Bâtiment Plateformes-Cancer
Contact : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Tarif : 22€/heure
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Blue
- Lasers (nm) : 405 / 488 / 561 / 633 / 740
- TL : BF / DIC
- Modalité : Tête confocale LSM 980
- Détecteur : Gasp 32 Quasar + NIR
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
- Accessoires : Detecteur Airyscan 2
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 800 nm.
- Amélioration de la résolution via l'utilisation de l'Airyscan 2 (120 nm)
- Module FRAP pour suivi de molécules.
- Module FRET pour analyse de proches interactions.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
- Incubateur contrôlant la température et l'apport en CO2.
Localisation : Faculté de Médecine - Bâtiment Plateformes-Cancer
Contact : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Tarif : 22€/heure
Description :
- Marque : Leica Stellaris 5
- Type de statif : Inversé
- Logiciel : LAS X
- Lasers (nm) : 405 / 488 / 561 / 633
- TL : BF
- Modalité : Tête confocale Stellaris 5
- Détecteur : Gasp 32 Quasar
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750 nm.
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour éliminer la dérive en Z.
Localisation : Faculté de Médecine - Bâtiment Plateformes-Cancer
Contact : Meryem Tardivel | Antonino Bongiovanni | 03.20.62.34.93
Campus Pasteur
Description :
- Marque : Zeiss Axio Observer Z1
- Type de statif : Inversé
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête confocale LSM 880
- Détecteur : Gasp 32 Quasar
- Objectifs : 10x/0.3 | 40x/1 (water) | 40x/1,3 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Chambre d'incubation Temp. et CO2 : PECON
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Definite Focus
- Accessoires : Detecteur FAST-Airyscan
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Amélioration de la résolution via l'utilisation de l'Airyscan (120 nm)
- Amélioration de la vitesse d'acquisition grâce à la tête GASP LSM 880
- Amélioration de la sensibilité grâce à la tête GASP LSM 880
- Module FRAP pour suivi de molécules.
- Module FRET pour analyse de proches interactions.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées dans le temps, multi-position et mosaïque.
- Système d’Autofocus intégré pour palier au phénomène de dérive en Z.
- Suivie de dynamique moléculaire et cellulaire dans le temps (contrôlé en température et CO2).
Localisation : Institut Pasteur de Lille - Institut de Biologie de Lille, 2ème étage
Contact : Sophie Salomé-Desnoulez | 03.20.87.10.40
Tarif : 22€/heure
Description :
- Marque : Zeiss Axio Imager Z1
- Type de statif : Droit
- Logiciel : ZEN Black
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- TL : BF / DIC
- Modalité : Tête confocale LSM 710
- Détecteur : PMT 32 Quasar, 2 GAsp BIG
- Objectifs : 10x/0.3 | 20/0.8 | 40x/1,4 (oil) | 63x/1,4 (oil) | Zoom numérique
- Platine : Motorisée
- Supports : Lame, boite 35mm (imagerie en immersion eau)
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Imagerie d’échantillons épais, en immersion en milieux aqueux (sphéroïdes en matrigel, drosophile ...)
- Observation d'échantillons fixés montés entre lame et lamelle.
- Détection simultanée de 6 couleurs de 400nm à 750nm.
- Démixage linéaire pour analyse spectrale des signaux.
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions automatisées multi-position et mosaïque.
Localisation : Institut Pasteur de Lille - Institut de Biologie de Lille, 2ème étage
Contact : Sophie Salomé-Desnoulez | 03.20.87.10.40
Tarif : 22€/heure
Description :
- Marque : Nikon - Gataca Systems
- Type de statif : Inversé
- Logiciel : Metamorph
- Lasers (nm) : 405 / 452 / 488 / 514 / 561 / 633
- Filtres d’émission: DAPI, CFP, GFP, YFP, dsRed, FarRed
- TL : BF / DIC
- Modalité : Tête Spinning Disk Yokogawa CSU-W1
- Détecteur : 2 caméras Prime 95B
- Objectifs : 20x/0.75 | 40x/0,95 | 40x/1,3 (oil) | 63x/1,27 (water) | 60x/1,4 (oil) | 100x/1,49 (oil) Zoom optique
- Platine : Motorisée et Z Piezo
- Chambre d'incubation Temp. et CO2 : Okolab
- Supports : Lames / Plaques multi-puits / Lames multi-chambres
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Perfect Focus
- Accessoires : Module Live-SR (amélioration optique et déconvolution Rsr=Robj/1,67)
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence.
- Détections en séquentiel de 4 couleurs et simultanée de 2 couleurs.
- Imagerie de haute résolution en Live-SR (taille pixel live SR 100X oil :0.065µm)
- Transmission, contraste interférentiel de Nomarski (DIC).
- Acquisitions temporelles à cadensage rapide (mode dual-cam, multi-position, maintient de focus, contrôle de la température et du C02). Applicable sur des échantillons infectieux manipulés en L2.
- Suivie de dynamiques moléculaires par FRAP (fluorescence recovery after photobleatching).
- Applications en TIRF (total internal reflection fluorescence) pour l’imagerie à faible profondeur des phénomènes observables à ou sous la membrane cellulaire.
- Étude d’interaction moléculaire par FRET (Föster resonance energy transfer) (couple GFP/RFP, CFP/YFP) en acquisition temporelle.
Localisation : Institut Pasteur de Lille - Institut de Biologie de Lille, 5ème étage (LNSB2)
Contact : Sophie Salomé-Desnoulez | 03.20.87.10.40
Tarif : 22€/heure
Description :
- Marque : Nikon
- Type de statif : Inversé
- Logiciel : NIS Elements
- Lasers (nm) : Lumencore Celesta 7 Lines 408 / 445 / 473 / 518 / 545 / 635 / 750
- Filtres d’émission: DAPI, FITC, TRITC, Cy5, Cy7
- TL : BF
- Modalité : Tête Spinning Disk CREST X-Light V3
- Détecteur : 1 caméra Photometrics Prime BSI
- Objectifs : 20x/0.75 | 40x/1,3 (oil) | 63x/1,4 (oil) | 100x/1,45 (oil)
- Platine : Motorisée et Z Piezo
- Chambre d'incubation Temp. et CO2 : Okolab
- Supports : Lames et dishes 15mm / Plaques multi-puits
- Z-Stacks : Oui
- Mosaïques : Oui
- Multi-positions : Oui
- Maintien de focus : Perfect Focus
- Accessoires : Module de déconvolution et d'amélioration de résolution par intelligence artificielle
Applications :
- Observation 2D ou 3D de tranche optique en fluorescence et transmission
- Détections en séquentiel de 5 couleurs.
- Quantification possible sur l'ensemble du champ par une illumination homogène
- Imagerie de haute résolution par outil software (taille pixel au 100x (oil): 0,067µm))
- Acquisitions temporelles à cadensage rapide (multi-position, maintien de focus, contrôle de la température et du C02). Applicable sur des échantillons manipulés en L2.
- Étude d’interaction moléculaire par FRET (Föster resonance energy transfer) (couple GFP/RFP, CFP/YFP) en acquisition temporelle.
Localisation : Institut Pasteur de Lille - Bâtiment Calmette, 3ème étage (LNSB2)
Contact : Sophie Salomé-Desnoulez | 03.20.87.10.40