Cytométrie et Imagerie en Flux
Présentation
Le plateau de Cytométrie du BICeL, réparti sur les campus Santé et de l’Institut Pasteur de Lille, propose un ensemble d’équipements et de compétences permettant la formation, le conseil et l’analyse en cytométrie en flux conventionnelle, en cytométrie spectrale, en tri cellulaire ainsi qu’en imagerie en flux.
Le plateau est ouvert à tous les utilisateurs académiques locaux, régionaux et nationaux ainsi qu’aux utilisateurs non-académiques issus de sociétés privées par exemple.
L’accès et le fonctionnement du plateau sont soumis à des règles définies dans les modalités d’accès aux plateaux du BICeL.
Qu'est-ce que la Cytométrie en Flux ?
La cytométrie conventionnelle
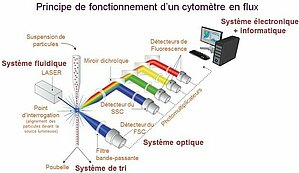
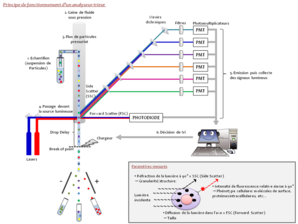
La cytométrie en flux est une technique biologique qui permet l'étude multiparamétrique précise, quantitative et qualitative de particules isolées en suspension entraînées par un flux liquide. La cytométrie conventionnelle regroupe (1) un système fluidique entrainant des cellules jusqu'à une ou des sources d'excitation, (2) un système de collection de la lumière émise (fluorescence), (3) une digitalisation du signal et (4) un logiciel d'analyse permettant d'interpréter les données.
Le sytème fluidique repose sur la focalisation hydrodynamique du flux de particules. Une pression légèrement supérieure à celle du liquide de gaine est appliquée à l'échantillon pour permettre la pénétration des particules dans le flux. Cette stratégie favorise l'alignement des particules les unes derrière les autres à l'entrée de la chambre d'analyse. Lorsque la pression appliquée à l'échantillon est augmentée pour accélérer la vitesse d'analyse, le flux de particules s'élargit. Celles-ci se distribuent alors plus aléatoirement dans le coeur du fluide, ce qui affecte l'homogénéité de l'excitation et de la collecte des signaux.
La cytométrie est aujourd'hui omniprésente, aussi bien utilisée dans les laboratoires d'analyses médicales que dans les laboratoires de recherche. On la retrouve égalment embarquée sur des navires, voire des bouées, pour des études de biologie marine dans lesquelles les pigments naturels des micro-organismes sont les principaux critères d'identification et de quantification des populations.
Instruments disponibles:
- Campus Santé
- Campus Pasteur
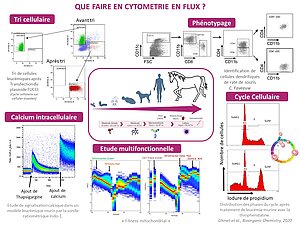
Tri Cellulaire
La cytométrie en flux conventionnelle permet le tri simultané d'une ou plusieurs populations de cellules monodispersées au cours d'une seule et même analyse.
Dans ce but, la veine liquide est chargée électriquement, puis fractionnée en une succession de gouttelettes par mise en vibration de la buse par un système piézo-électrique qui déterminera la fréquence de formation des gouttelettes. La gouttelette contenant la cellule voulue est déviée en passant dans un champ électrostatique et récupérée dans un récipient collecteur. Si la cellule appartient à une sous-population non sélectionnée ou si la gouttelette formée ne contient pas de cellule, la veine liquide ne sera pas chargée et la gouttelette éliminée. Le tri cellulaire nécessite une très grande stabilité du jet formé pour garantir une pureté des populations récoltées.
Il est possible de trier, suivant les appareils, de 1 à 6 populations différentes simultanément en tubes ou bien de récupérer les cellules directement en plaques de culture (6, 12, 24, 96 puits...).
Instruments disponibles:
- Campus Santé
- Campus Pasteur
La cytométrie Acoustique
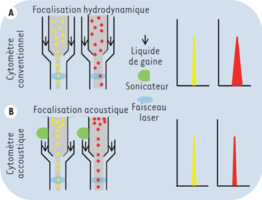
En cytométrie acoustisque, la focalisation du flux n'est plus hydrodynamique. Grâce à une sonde de sonication adjointe à l'entrée de la cuvette d'analyse, le flux devient indépendant de la pression exercée par le liquide de gaine et les particules s'alignent sur le coeur du fluide, recevant alors la même excitation par les faisceaux lasers. Les ultrasons émis par la sonde de sonication sont similaires à ceux utilisés pour les échographes.
Cette amélioration autorise des vitesses de passage de cellules beaucoup plus importantes, de l'ordre de 5 à 10 fois par rapport à la focalisation hydrodynamique, et sans perte de la qualité du signal.
Instrument disponible:
- Campus Pasteur
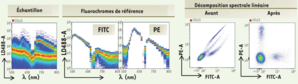
La cytométrie Spectrale
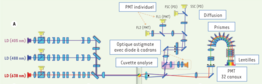
La cytométrie spectrale permet un échantillonage du spectre émis par un fluorochrome à haute résolution. Dans la chambre d'analyse, les cellules sont soumises séquentiellement à un laser 488nm puis à la combinaison de deux lasers 405 et 638nm. L'optique de séparation spectrale est composée de 10 prismes. Ils étalent la fluorescence émise entre 500 et 800nm et a dirige vers une série de lentilles qui concentrent la lumière sur un photomultiplicateur.
Le signal de fluorescence d'un échantillon multimarqué se résume alors en la somme de la fluorescence des anticorps couplés aux fluorochromes utilisés et au bruit de fond provenant des cellules elles-mêmes. Un algorithme mathématique de décomposition linéaire permet de déduire l'abondance de chacune des sondes à paritr de l'empreinte spectrale de l'échantillon multimarqué et des spectres de référence des molécules fluorescentes utilisées.
Ainsi, après l'acquisition des échantillons puis application de la décomposition spectrale, les données obtenues peuvent être analysées.
Instrument disponible:
- Campus Santé
Quand utiliser la Cytométrie en Flux ?
- Immunophénotypage multicouleurs
- Cycle cellulaire
- Potentiel mitochondrial, apoptose, stress oxydatif, masse mitochondriale
- Analyse des microorganismes, spermatozoïdes, insectes, bactéries, animaux marins
- Comptage absolu
- Clonage
- Détection, caractérisation et tri d’évènements rares tels que les cellules souches
- Echantillons vivants ou fixés
Liens Utiles
- Miltenyi: Miltenyi Biotec | Biotechnology Company | France
- Biolegend: BioLegend | Your Partner for Antibodies, Proteins, Kits, Proteogenomics, Custom Services, and Reagents in Life Science
- Life Technologies: Life Technologies | Thermo Fisher Scientific - FR
- eBiosciences: eBioscience | Thermo Fisher Scientific - FR
- Sony Biotechnologies : Flow Cytometry Reagents - Reagents (sonybiotechnology.com)
- BD Biosciences: Research Reagents | Conjugated Reagents (bdbiosciences.com)
- Beckman Coulter: Flow Cytometry Reagents, DuraClone IM - Beckman Coulter
- Ozyme: Anticorps et produits liés (ozyme.fr)
- Abcam: Antibodies, Proteins, Kits and Reagents for Life Science | Abcam
- Biorad: Flow Cytometers | Bio-Rad Laboratories
- ThermoFisher Scientific: Fluorescence SpectraViewer | Thermo Fisher Scientific - FR
- BD Biosciences: Spectrum Viewer | BD Biosciences-US
- Miltenyi Biotec: Spectra Viewer | Fluorescence | Tools Miltenyi Biotec | France
- Biolegend : Spectra Analyzer (biolegend.com)
- Fluorofinder: FluoroFinder 2.0
- ThermoFisher Scientific : Flow Cytometry Panel Builder | Thermo Fisher Scientific - FR
- BD Biosciences : BD Horizon™ Guided Panel Solution (GPS) tool | BD Biosciences-US
- Biolegend: Flow Cytometry Tools (biolegend.com)
Design Panels Multicouleurs
- https://www.bdbiosciences.com/en-fr/resources/reagent-selection-tools/interactive-cell-map
- https://www.bdbiosciences.com/content/dam/bdb/marketing-documents/Fluorochrome-Chart-Relative-Brightness.pdf
- https://www.bdbiosciences.com/content/dam/bdb/marketing-documents/Design%20of%20Multicolor%20Flow%20Cytometry%20Panels%20Incorporating%20BD%20Horizon%E2%84%A2%20Brilliant%20Violet%E2%84%A2%20Dyes_webinar_071713_multicolor-bv.pdf
- https://www.bdbiosciences.com/en-fr/learn/applications/multicolor-flow-cytometry/lasers-and-dyes#overview
Guides de sélection
- ThermoFisher Sicentific: https://assets.thermofisher.com/TFS-Assets/LSG/brochures/immune-cell-guide.pdf
- Becton Dickinson : BD Biosciences Fluorochrome Reference Guide
- eBioscience : multicolor-flow-cytometry-tech-resource-guide.pdf
- Biolegend/marqueurs cellulaires: Cell Markers (biolegend.com)
- Biolegend/voies de signalisation Pathways Library (biolegend.com)
- Becton Dickinson (concordance λ fluorochrome / λ laser): Fluorochrome/Laser Reference Poster
- ICMS-UK (aide à la sélection des réactifs): Viability, Flow Cytometry Core Facility (qmul.ac.uk)
- Kaluza : Kaluza, Logiciel d’analyse de cytométrie en flux - Beckman Coulter
- FlowJo : Home | FlowJo, LLC
- ModFit : ModFit LT™ (vsh.com)
- CytExpert : Logiciel CytExpert pour la plateforme CytoFLEX - Beckman Coulter
Version d'essai gratuite 30 jours
- OMIQ: https://www.omiq.ai/
Le plateau dispose d'une licence de site pouvant être mise à disposition des utilisateurs (se renseigner aupèrs des personnles du plateau)
- BD Biosciences : Biosciences | BD Biosciences-EU
- Beckman Coulter : Life Sciences Home - Beckman Coulter
- Sony Biotechnologies : Sony Biotechnology Inc.
- ThermoFisher Scientific : Thermo Fisher Scientific - FR
- CYTEK: Full Spectrum Flow Cytometry Systems | Discover the Advantages | Cytek Biosciences