Citometría de flujo
Presentación:
La plataforma de citometría del BICeL, situada en los campus Santé y del Instituto Pasteur de Lille, ofrece una serie de equipos y competencias para la formación, el asesoramiento y el análisis en citometría de flujo convencional, citometría espectral, clasificación de células e imágenes de flujo.
La plataforma está abierta a todos los usuarios académicos locales, regionales y nacionales, así como a usuarios no académicos de empresas privadas, por ejemplo.
El acceso y el funcionamiento de la plataforma están sujetos a las normas definidas en las condiciones de acceso a la plataforma BICeL.
¿Qué es la citometría de flujo?
Citometría convencional
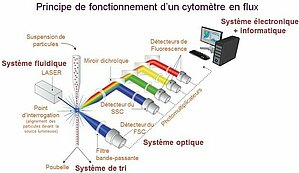
La citometría de flujo es una técnica biológica que permite el estudio preciso, cuantitativo y cualitativo multiparamétrico de partículas aisladas en suspensión transportadas por un flujo líquido. La citometría convencional consta de (1) un sistema fluídico que conduce las células hacia una o varias fuentes de excitación, (2) un sistema de recogida de la luz emitida (fluorescencia), (3) una digitalización de la señal y (4) un software de análisis para interpretar los datos.
El sistema fluídico se basa en la focalización hidrodinámica del flujo de partículas. Se aplica a la muestra una presión ligeramente superior a la del fluido de la vaina para permitir que las partículas penetren en el flujo. Esta estrategia favorece la alineación de las partículas una detrás de otra a la entrada de la cámara de análisis. Cuando se aumenta la presión aplicada a la muestra para acelerar la velocidad de análisis, el flujo de partículas se amplía. Esto da lugar a una distribución más aleatoria de las partículas en el fluido del núcleo, lo que afecta a la homogeneidad de la excitación y la recogida de la señal.
La citometría es ahora omnipresente, y se utiliza tanto en los análisis médicos como en los laboratorios de investigación. También se utiliza a bordo de barcos e incluso de boyas para estudios de biología marina en los que los pigmentos naturales de los microorganismos son el principal criterio para identificar y cuantificar las poblaciones.
Instrumentos disponibles:
- Campus Santé
- LSR Fortessa X20
- CytoflexLX
- Campus Pasteur
- LSR Fortessa
Clasificación celular
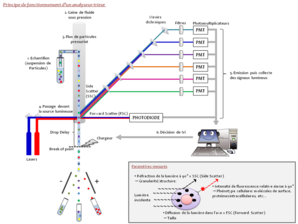
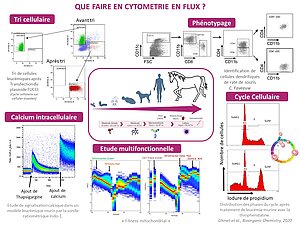
La citometría de flujo convencional permite la clasificación simultánea de una o más poblaciones celulares monodispersas en un solo análisis.
Para ello, la corriente de líquido se carga eléctricamente y luego se fracciona en una sucesión de gotas haciendo vibrar la boquilla con un sistema piezoeléctrico que determina la frecuencia de formación de las gotas. La gota que contiene la célula deseada se desvía al pasar por un campo electrostático y se recoge en un recipiente de recogida. Si la célula pertenece a una subpoblación no seleccionada o si la gota formada no contiene una célula, el flujo de líquido no se cargará y la gota se descartará. La clasificación de células requiere una estabilidad muy alta del spray formado para garantizar la pureza de las poblaciones cosechadas.
Dependiendo del equipo, es posible clasificar de 1 a 6 poblaciones diferentes simultáneamente en tubos o recuperar las células directamente en placas de cultivo (6, 12, 24, 96 pocillos, etc.).
Instrumentos disponibles:
- Campus Santé
- Campus Pasteur
Citometría acústica
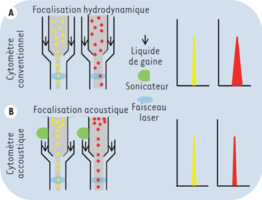
En la citometría acústica, el foco del flujo ya no es hidrodinámico. Con una sonda de sonicación conectada a la entrada de la cubeta de análisis, el flujo se vuelve independiente de la presión ejercida por el fluido de la vaina y las partículas se alinean con el núcleo del fluido, recibiendo la misma excitación por los rayos láser. Los ultrasonidos emitidos por la sonda de sonicación son similares a los utilizados en los ecógrafos.
Esta mejora permite tasas de paso de células mucho más altas, del orden de 5 a 10 veces en comparación con el enfoque hidrodinámico, y sin pérdida de calidad de la señal.
Instrumento disponible:
- Campus Pasteur
- Attune NxT
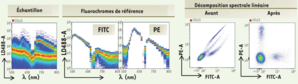
Citometría espectral
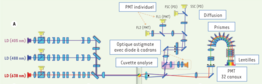
La citometría espectral permite el muestreo del espectro emitido por un fluorocromo a alta resolución. En la cámara de análisis, las células se someten secuencialmente a un láser de 488 nm y luego a la combinación de dos láseres de 405 y 638 nm. La óptica de separación espectral consta de 10 prismas. Difunden la fluorescencia emitida entre 500 y 800 nm y la dirigen a una serie de lentes que enfocan la luz hacia un fotomultiplicador.
La señal de fluorescencia de una muestra multietiquetada se resume entonces en la suma de la fluorescencia de los anticuerpos acoplados a los fluorocromos utilizados y el ruido de fondo de las propias células. Se utiliza un algoritmo matemático de descomposición lineal para deducir la abundancia de cada sonda a partir de la huella espectral de la muestra multietiquetada y de los espectros de referencia de las moléculas fluorescentes utilizadas.
Así, tras la adquisición de la muestra y la aplicación de la descomposición espectral, se pueden analizar los datos obtenidos.
Instrumento disponible:
- Campus Santé
- SP6800
¿Cuándo utilizar la citometría de flujo?
- Inmunofenotipo multicolor
- Ciclo celular
- Potencial mitocondrial, apoptosis, estrés oxidativo, masa mitocondrial
- Análisis de microorganismos, espermatozoides, insectos, bacterias, animales marinos
- Recuento absoluto
- Clonación
- Detección, caracterización y clasificación de eventos raros como las células madre
- Muestras vivas o fijas
Enlaces de interés
- Miltenyi: Miltenyi Biotec | Biotechnology Company | France
- Biolegend: BioLegend | Your Partner for Antibodies, Proteins, Kits, Proteogenomics, Custom Services, and Reagents in Life Science
- Life Technologies: Life Technologies | Thermo Fisher Scientific - FR
- eBiosciences: eBioscience | Thermo Fisher Scientific - FR
- Sony Biotechnologies : Flow Cytometry Reagents - Reagents (sonybiotechnology.com)
- BD Biosciences: Research Reagents | Conjugated Reagents (bdbiosciences.com)
- Beckman Coulter: Flow Cytometry Reagents, DuraClone IM - Beckman Coulter
- Ozyme: Anticorps et produits liés (ozyme.fr)
- Abcam: Antibodies, Proteins, Kits and Reagents for Life Science | Abcam
- Biorad: Flow Cytometers | Bio-Rad Laboratories
- ThermoFisher Scientific: Fluorescence SpectraViewer | Thermo Fisher Scientific - FR
- BD Biosciences: Spectrum Viewer | BD Biosciences-US
- Miltenyi Biotec: Spectra Viewer | Fluorescence | Tools Miltenyi Biotec | France
- Biolegend : Spectra Analyzer (biolegend.com)
- Fluorofinder: FluoroFinder 2.0
- ThermoFisher Scientific : Flow Cytometry Panel Builder | Thermo Fisher Scientific - FR
- BD Biosciences : BD Horizon™ Guided Panel Solution (GPS) tool | BD Biosciences-US
- Biolegend: Flow Cytometry Tools (biolegend.com)
Guías de selección
- ThermoFisher Sicentific: https://assets.thermofisher.com/TFS-Assets/LSG/brochures/immune-cell-guide.pdf
- Becton Dickinson : BD Biosciences Fluorochrome Reference Guide
- eBioscience : multicolor-flow-cytometry-tech-resource-guide.pdf
- Biolegend/marcadores celulares: Cell Markers (biolegend.com)
- Biolegend/vías de señalización Pathways Library (biolegend.com)
- Becton Dickinson (λ fluorocromo / λ láser match): Fluorochrome/Laser Reference Poster
- ICMS-UK (asistencia en la selección de reactivos): Viability, Flow Cytometry Core Facility (qmul.ac.uk)
- Kaluza : Kaluza, Logiciel d’analyse de cytométrie en flux - Beckman Coulter
- FlowJo : Home | FlowJo, LLC
- ModFit : ModFit LT™ (vsh.com)
- CytExpert : Logiciel CytExpert pour la plateforme CytoFLEX - Beckman Coulter
Versión de prueba gratuita de 30 días
- OMIQ: https://www.omiq.ai/
La plataforma dispone de una licencia de sitio que puede ponerse a disposición de los usuarios (pida los detalles al personal de la plataforma).
- BD Biosciences : Biosciences | BD Biosciences-EU
- Beckman Coulter : Life Sciences Home - Beckman Coulter
- Sony Biotechnologies : Sony Biotechnology Inc.
- ThermoFisher Scientific : Thermo Fisher Scientific - FR
- CYTEK: Full Spectrum Flow Cytometry Systems | Discover the Advantages | Cytek Biosciences

![[Translate to Spanish:] Accès à l'un des organismes partenaires : CNRS [Translate to Spanish:] Organisme partenaire](/fileadmin/_processed_/0/1/csm_CNRS_3a745ef80f.png)
![[Translate to Spanish:] Accès à l'un des organismes partenaires : INSERM [Translate to Spanish:] Organisme partenaire](/fileadmin/_processed_/f/f/csm_1200px-Inserm.svg_e391664898.png)
![[Translate to Spanish:] Accès à l'un des organismes partenaires : CHU Lille [Translate to Spanish:] Organisme partenaire](/fileadmin/_processed_/b/b/csm_chu_25c6c9f960.png)
![[Translate to Spanish:] Accès à l'un des organismes partenaires : Institut Pasteur de Lille [Translate to Spanish:] Organisme partenaire](/fileadmin/_processed_/6/1/csm_pasteur_21b9760e1f.png)